日本順天堂大學(xué):開始無免疫抑制劑肝移植臨床試驗
日本順天堂大學(xué)的奧村康特任教授和內(nèi)田浩一郎副教授主導(dǎo)的研究團隊,向日本PMDA提交了關(guān)于實施“評估誘導(dǎo)型抑制性T細胞(以下簡稱JB-101)在活體肝移植中的免疫耐受誘導(dǎo)能力及安全性的I/II期臨床試驗”申請,將啟動由醫(yī)生主導(dǎo)的臨床試驗。
肝移植是嚴重性肝疾病(肝功能衰竭、肝硬化)的重要治療方式之一。肝移植術(shù)后患者需長期服用免疫抑制劑,以維持供體器官功能正常,抑制免疫排斥反應(yīng)。但是,長期服用免疫抑制劑,也會產(chǎn)生例如易感冒、易感染、糖尿病?腎功能障礙、致癌等副作用。由于這種副作用,移植患者的生活受到嚴重限制,除了嚴格的自我管理及不斷增加的藥物,生活質(zhì)量低下仍然是亟待解決的問題。
順天堂大學(xué)團隊在研究中發(fā)現(xiàn)了誘導(dǎo)型抑制性T細胞(JB-101),這種T細胞會針對性地抑制對供體器官的免疫排斥反應(yīng),可長期誘導(dǎo)無排斥的免疫耐受狀態(tài),并于2016年利用誘導(dǎo)型抑制性T細胞成功地讓肝移植患者完全脫離了免疫抑制劑。
此外,2019年通過與順天堂大學(xué)創(chuàng)辦的新藥開發(fā)初創(chuàng)企業(yè)JUNTEN BIO開展聯(lián)合研究,還成功確立了穩(wěn)定制造誘導(dǎo)型抑制性T細胞(JB-101)的方法。同時,順天堂大學(xué)將在日本移植學(xué)會的支持下,聯(lián)合東京女子醫(yī)科大學(xué)、廣島大學(xué)和長崎大學(xué)共同實施由醫(yī)生主導(dǎo)的評估JB-101的有效性和安全性的臨床試驗,以實現(xiàn)無需使用免疫抑制劑的肝移植療法。
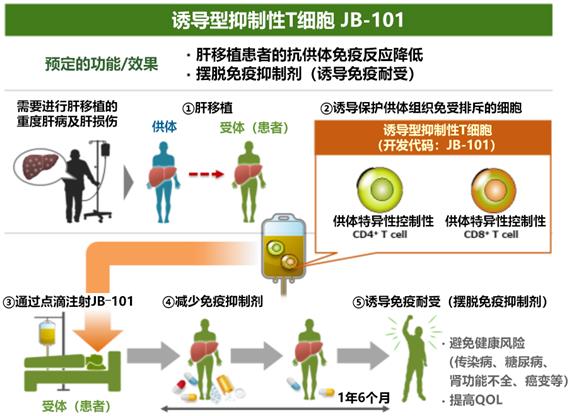
圖1:JB-101的免疫耐受誘導(dǎo)機制
臨床試驗概要
此次臨床試驗征得患者同意后將在實施肝移植前的觀察期進行篩查,以確認是否適合參加臨床試驗,然后利用單采術(shù)(Apheresis)在實施肝移植的14天前~3天前從供體、在實施肝移植的前一天從受試者體內(nèi)采集外周血單核細胞。將從供體和受試者體內(nèi)采集的白細胞中的單核細胞與CD80/CD86抗體(激活T細胞的分子)進行共培養(yǎng),培養(yǎng)的單核細胞會轉(zhuǎn)化成保護供體組織免受排斥的細胞(誘導(dǎo)型抑制性T細胞“JB-101”)。
作為注射JB-101的預(yù)處理,為暫時減少體內(nèi)的淋巴細胞,在實施肝移植后的第五天投用環(huán)磷酰胺。然后在實施肝移植10天或11天后為患者注射JB-101,利用約1年零6個月的時間觀察是否會發(fā)生排斥反應(yīng),并逐漸減少免疫抑制劑的用量,最終徹底停用免疫抑制劑(擺脫免疫抑制劑)。
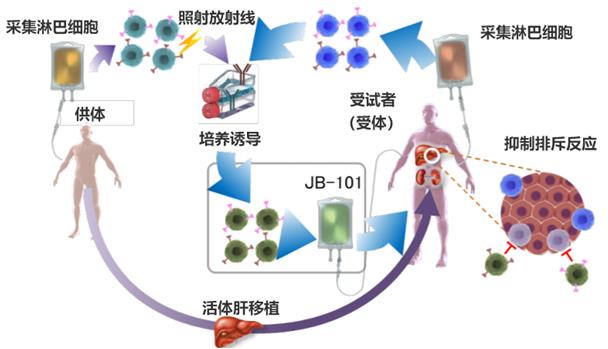
圖2:JB-101的制造流程圖
臨床試驗把擺脫免疫抑制劑超過1年以上的情況定義為“免疫耐受”,將評估JB-101的效果。臨床試驗的結(jié)果將提交給厚生勞動省進行審查。如果確認效果和安全性沒有問題,將作為再生醫(yī)療等的產(chǎn)品通過審批(計劃2026年內(nèi)實現(xiàn))。該臨床試驗的目標是使順天堂及日本的再生醫(yī)療技術(shù)實現(xiàn)實用化,作為向全球推廣的第一步。
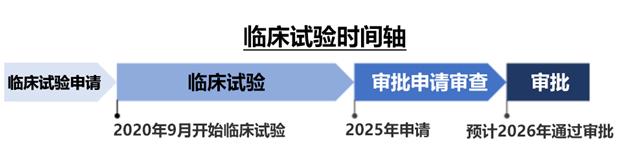
圖3:該臨床試驗的時間軸(預(yù)定計劃)
關(guān)于順天堂大學(xué)
順天堂大學(xué)(英文:Juntendo University),簡稱順大或順天堂,日本著名私立醫(yī)學(xué)院,是日本極負盛名的世界級頂尖學(xué)府,也是日本歷史最悠久的綜合醫(yī)學(xué)機構(gòu)之一。該校建立于1838年,至今已有百年歷史,以醫(yī)學(xué)、國際醫(yī)療為中心。
關(guān)于順天堂醫(yī)院
順天堂醫(yī)院是順天堂大學(xué)的大學(xué)附屬醫(yī)院,成立于1838年,前身是當時日本早引入西醫(yī)的醫(yī)學(xué)塾—和田塾。順天堂雖然是一家私立的大型綜合性醫(yī)院,但其綜合排名已經(jīng)連續(xù)數(shù)年居日本前3,擁有鈴木健司(胸外科)、天野篤(心臟外科)、山高篤行(小兒外科)等名醫(yī)。
對于希望至順天堂醫(yī)院就診的國內(nèi)患者,日本就醫(yī)網(wǎng)可提供從咨詢轉(zhuǎn)診、預(yù)約就診、辦理醫(yī)療簽證、安排醫(yī)療翻譯等一站式就醫(yī)服務(wù),致力于提供快速、安心、安全的服務(wù)體驗。


