個性化癌癥疫苗可提高免疫療法的有效性
mRNA腫瘤疫苗 + 阿替利珠單抗(Atezolizumab)用于晚期實體癌
RO7198457一種基于信使RNA(mRNA)的新抗原特異性疫苗,有望通過增加新抗原特異性T細胞來增強免疫檢查點抑制劑(ICI)的抗腫瘤作用。
英國皇家馬斯登醫院的Juanita Lopez在美國癌癥研究協會(AACRVirtual Annual Meetings Ⅱ,6月22~24日,線上)上報道了RO7198457在局部晚期/轉移性實體瘤患者中的Ib期臨床試驗結果

每位患者都擁有自己的腫瘤特異性新抗原
RO7198457是根據每位患者量身定制的“個性化癌癥疫苗”。需要對患者的血液樣品和腫瘤組織進行序列分析,并鑒定多達20種腫瘤特異性新抗原,然后合成相應的mRNA以制備脂質體制劑并靜脈回輸到人體。疫苗會刺激先天的免疫系統,并通過抗原呈遞細胞(DC細胞)激活靶向新抗原的抗腫瘤免疫力。
此次研究,我們針對符合以下標準的患者:
(1)18歲或以上;
(2)晚期或復發性實體癌;
(3)預期壽命超過12周,
(4)全身狀況(ECOG PS評分)為1以下。
該測試以21天為1個周期。RO7198457給藥:前面2個周期每周一次;第3個周期每2周一次。只要沒有病情沒有進展,在第7和第13個周期,以及每8個周一次。阿替利珠單抗(Atezolizumab)每3周一次。
【主要終點】:藥物的安全性和耐受性
【次要終點】: 最大耐受劑量,II期試驗的推薦劑量,藥代動力學,抗腫瘤活性。
這項研究分為劑量遞增隊列(30名受試者)和劑量擴展隊列(114名受試者)。劑量擴展隊列中,曾經接受過ICI治療42例,未曾接受過ICI治療72例。
從劑量遞增隊列和劑量擴展隊列(有/無ICI)的患者背景來看
《中位年齡》:57.5歲,61.5歲/57.5歲;
《ECOG PS 0分》:50.0%,45.2%/ 52.8%;
《轉移性病變全身治療的中位治療史》:4線,3線/ 2線;
《ICI治療史》:43.3%,100%/ 0%;
《PD-L1表達腫瘤浸潤免疫細胞(IC)或腫瘤細胞(TC)》
<5%的是80.0%,50.0%/ 75.0%,
≥5%或更高的是16.7%,28.6%/ 13.9%。
在劑量遞增隊列中,大腸癌占30%,黑色素瘤占16.7%,直腸癌和腎細胞癌各占10%。
在劑量擴展列隊中
接受過ICI治療的,非小細胞肺癌(NSCLC)為71.4%,黑色素瘤率為19.0%;未經ICI治療的非小細胞肺癌為13.9%,黑色素瘤和腎細胞癌各為12.5%,三陰性乳腺癌占33.3%,尿路癌占13.9%。
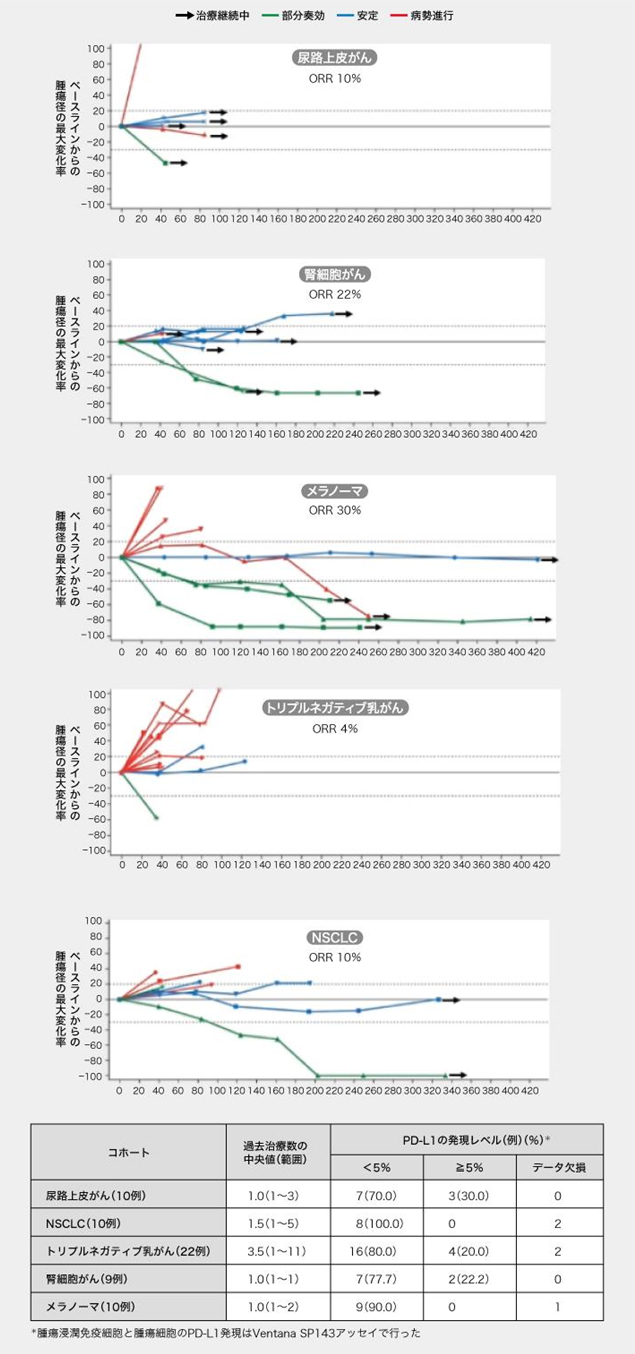
疫苗有效率: 22%的腎細胞癌,39%的黑素瘤
從這兩個隊列的總共144例受試者的RO7198457劑量來看,15μg為27例,25μg為95例,38μg為11例,50μg為9例;RO7198457按劑量劃分的中位治療期分別為65天, 57天, 64天, 36天;阿替利珠單抗的中位治療時間分別為104天,64天,106天,22天。開始治療后的6周內,分別有2例,19例,1例和2例患者因疾病進展而中斷治療。
不良反應中,常見發燒和畏寒。但總體上都是一過性的,而重癥。在個劑量級別中均未觀察到毒性限制劑量。
當通過ELISPOT方法和MHC多聚體方法評估疫苗接種后的新抗原反應時,進行評估的63例病例中,有46例(73%)發現了新抗原特異性反應,中位值為2.6(范圍1-9)。 有14例均與CD4和CD8陽性T細胞發生了反應。
未接受過ICI治療的劑量擴展隊列的患者中, 聯用RO7198457(25μg )和阿替利珠單抗的客觀緩解率(ORR),在尿路癌中為10%,在腎細胞癌中為22%,在黑色素瘤中為30%,在三陰性乳腺癌中為4%,在非小細胞肺癌中為10%。
圖表:未接受過ICI治療患者的緩解率狀況(根據AACR 2020發布的數據創建)
根據以上研究數據,Lopez說:“一般來說,RO7198457聯用阿替利珠單抗的組合耐受性良好,尚無最大耐受劑量,也未觀察到毒性劑量限制” ,“這種組合在大多數患者中可激活炎性細胞因子的釋放和外周T細胞反應。”
目前,作為RO7198457的II期臨床試驗,研究者們正在驗證與pembrolizumab(派姆單抗)聯合用于一線治療黑色素瘤患者和聯用atezolizumab(阿替利珠單抗)作為NSCLC患者術后輔助治療的可行性。


